Reorganisation des Gehirns
Mechanismen der zerebralen Reorganisation
Die sensorische Wahrnehmung aber auch motorische, sprachliche und intellektuelle Fähigkeiten können durch gezieltes Training verbessert werden. Im Rahmen von Rehabilitationsmaßnahmen können sich Patienten von Funktionsstörungen infolge neurologischer Erkrankungen erholen.
Die neurowissenschaftliche Forschung hat in den vergangenen Jahren grundlegende Mechanismen im Tierexperiment beschrieben. Besonders wichtige Erkenntnisse sind dabei gewesen, dass räumlich und zeitlich verbundene Reize eine langfristige Verstärkung der synaptischen Signalübertragung zwischen Nervenzellen hervorrufen und damit Veränderungen der zerebralen Funktionsrepräsentation induzieren (Jacobs und Donoghue 1991, Darian-Smith und Gilbert 1994, Wang et al. 1995, Fitzsimonds et al. 1997, Nagarajan et al. 1998). Außerdem wurde nachgewiesen, dass plastische Veränderungen in der Hirnrinde die Beteiligung von Kerngebieten im sogenannten basalen Vorderhirn erfordern, was die Netzwerk-Hypothese der zerebralen Reorganisationsmechanismen unterstützt (Kilgard und Merzenich 1998, Witte et al. 2000). Besondere Bedeutung haben die Untersuchungen von Nudo und Mitarbeiten (Nudo et al. 1996, Frost et al. 2003), nach denen gezieltes Training eine Vergrößerung der Funktionsrepräsentation von Bewegungen in motorischen Kortexarealen induziert, während nicht trainierte Affen keine Funktionsverbesserung und keine Veränderung der kortikalen Repräsentation zeigten. Demnach ermöglicht die Reorganisation in Folge von Hirnschäden eine Funktionserholung, wobei die periläsionelle Region aber auch funktionell verwandte, entfernt liegende Hirnareale beteiligt sind.
Beim Menschen können die Mechanismen der zerebralen Reorganisation mit den nicht-invasiven Verfahren der funktionellen Bildgebung und Elektrophysiologie untersucht werden. Beispielsweise haben Classen und Mitarbeiter (1998) zeigen können, dass in einer übungsabhängigen Weise die kortikale Repräsentation von Fingerbewegungen geändert werden kann. Probanden mußten nach Stimulation mit der transkraniellen Magnetstimulation wiederholt eine Bewegung entgegengesetzt zu der evozierten Bewegung ausführen. Nach dem Training rief die transkranielle Magnetstimulation eine Daumenbewegung in der neu geübten Richtung hervor. Diese Effekte sind pharmakologisch zu fördern oder zu unterdrücken, wobei gezeigt werden konnte, dass die kortikale Plastizität durch Langzeit-Veränderungen der synaptischen Funktion bedingt ist (Bütefisch et al. 2000). Demnach reorganisiert sich das Gehirn täglich entsprechend der jeweils gestellten Anforderungen. Vergleichbare Ergebnisse wurden auch bei Patienten nach Hirninfarkten erzielt (Liepert et al. 1998).
Bildgebende Untersuchungen zeigten, dass bei Patienten, die sich von einem Hirninfarkt erholt hatten, Hirnregionen aktiviert werden, die bei Gesunden, die dieselbe Aufgabe ausführen, nicht aktiv werden (Weiller et al. 1992, Weiller et al. 1993, Weder et al. 1994, Cramer et al. 1997, Seitz et al. 1998, Calautti et al. 2001). Diese Veränderungen können in Nachbarschaft zum Hirninfarkt oder in der gegenseitigen Hirnhälfte auftreten (Marshall et al. 2000, Binkofski and Seitz 2004). Damit ist es also möglich nachzuweisen, welche Hirnareale bei der Erholung von einer Halbseitenlähmung oder einer Sprachstörung beteiligt sind. Außerdem können die Interaktion verschiedener Hirnareale und Veränderungen ihrer Erregbarkeit in Folge von Hirnkrankheiten erfaßt werden. Offensichtlich ist die Interaktion der Hirnareale durch eine Hirnläsion weiträumig und gravierend verändert, was sich unter gezielter Aktivitätsbeeinflussung mit der transkraniellen Magnetstimulation nachweisen läßt (Johansen-Berg et al. 2002, Bütefisch et al. 2003).
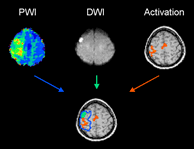
Ein entscheidender Prädiktor für eine Funktionserholung nach Hirninfarkt ist aber die funktionelle Integrität des ursprünglich funktionstragenden Hirngewebes (Binkofski et al. 1996, 2001, Netz et al. 1997, Crafton et al. 2003, Kleiser et al. 2005). Dies ist in der Abbildung dargestellt. Derzeit beschäftigt sich die rehabilitative Neurobiologie darüber hinaus mit den funktionellen Determinanten, der zeitlichen Abfolge, den physiologischen Mechanismen und dem Effekt von Lernstrategien auf die zerebralen Mechanismen, die der Neurorehabilitation zu Grunde liegen (Seitz et al. 2004). Auf diese Weise können die in Tierexperimenten gewonnenen, modellhaften Erkenntnisse hinsichtlich ihrer Tragfähigkeit überprüft und auf den Menschen übertragen werden.
Abb.: Zusammengeführte Information der akuten Durchblutungsstörung (Perfusionsbildgebung, PWI) und der strukturellen Hirnläsion (Diffusionsbildgebung, DWI) bei einem akuten Hirninfarkt. Aktivierungskarte bei Fingerbewegungen mit der erholten Hand mit Aktivität (rot) innerhalb des vormals mangeldurchbluteten Hirngewebes (blau) angrenzend an die Infarktläsion (grün). Aus Kleiser et al., NeuroImage 2005.
Ausgewählte Literatur
Binkofski F, Seitz RJ, Arnold S, Classen J, Benecke R, Freund HJ (1996) Thalamic metbolism and corticospinal tract integrity determine motor recovery in stroke. Ann Neurol 39: 460-470
Binkofski F, Seitz RJ, Hackländer T, Pawelec D, Mau J, Freund H-J (2001) The recovery of motor functions following hemiparetic stroke: a clinical and MR-morphometric study. Cerebrovasc Dis 11: 273-281
Binkofski F, Seitz RJ (2004) Modulation of the BOLD-response in early recovery from sensorimotor stroke. Neurology 63: 1223-1229
Bütefisch CM, Davis BC, Wise SP, Sawaki L, Kopylev L, Classen J, Cohen LG (2000) Mechanisms of use-dependent plasticity in the human motor cortex. Proc Natl Acad Sci USA 97: 3661-3665
Bütefisch CM, Netz J, Wessling M, Seitz RJ, Hömberg V (2003) Remote changes in cortical excitability after stroke. Brain 126: 470-481
Calautti C, Leroy F, Guincestre JY, Baron JC (2001) Dynamics of motor network overactivation after striatocapsular stroke: a longitudinal PET study using a fixed-performance paradigm. Stroke 32: 2534-2542
Classen J, Liepert J, Wise SP, Hallett M, Cohen LG (1998) Rapid plasticity of human cortical movement representation induced by practice. J Neurophysiol 79: 1117-1123
Crafton K, Mark A, Cramer S. Improved understanding of cortical injury by incorporating measures of functional anatomy. Brain. 2003;126:1650-1659
Cramer SC, Nelles G, Benson RR, Kaplan JD, Parker RA, Kwong KK, Kennedy DN, Finklestein SP, Rosen BR (1997) A functional MRI study of subjects recovered from hemiparetic stroke. Stroke 28: 2518-27
Darian-Smith C, Gilbert CD (1994) Axonal sprouting accompanies functional reorganization in adult cat striate cortex. Nature 368: 737-740
Fitzsimonds RM, Song HJ, Poo MM (1997) Propagation of activity-dependent synaptic depression in simple neural networks. Nature 388: 439-448
Frost SB, Barbay S, Friel KM, Plautz EJ, Nudo RJ (2003) Reorganization of remote cortical regions after ischemic brain injury: a potential substrate for stroke recovery. J Neurophysiol 89: 3205-3214
Jacobs KM, Donoghue JP (1991) Reshaping the cortical motor map by unmasking latent intracortical connections. Science 251: 944-947
Johansen-Berg H, Rushworth MF, Bogdanovic MD, Kischka U, Wimalaratna S, Matthews PM. The role of ipsilateral premotor cortex in hand movement after stroke. Proc Natl Acad Sci U S A 2002; 99: 14518-14523
Kilgard MP, Merzenich MM (1998) Cortical map reorganization enabled by nucleus basalis activity. Science 279: 1714-1718
Kleiser R, Wittsack H-J, Bütefisch CM, Jörgens S, Seitz RJ (2005) Functional activation within the PI-DWI mismatch region in recovery from hemiparetic stroke: preliminary observations. Neuroimage 24: 515-523
Liepert J, Miltner WH, Bauder H, Sommer M, Dettmers C, Taub E et al (1998) Motor cortex plasticity during constraint-induced movement therapy in stroke patients. Neurosci Lett 250: 5-8
Marshall R, Perera G, Lazar R, Krakauer J, Constantine R, DeLaPaz R. Evolution of cortical activation during recovery from corticospinal tract infarction. Stroke. 2000;31:656-661
Nagarajan SS, Blake DT, Wright BA, Byl N, Merzenich MM (1998) Practice-related improvements in somatosensory interval discrimination are temporally specific but generalize across skin location, hemisphere, and modality. J Neurosci 18: 1559-1570
Netz J, Lammers T, Homberg V (1997) Reorganization of motor output in the non-affected hemisphere after stroke. Brain 120: 1579-1586
Nudo RJ, Wise BM, SiFuentes F, Milliken GW (1996) Neural substrates for the effects of rehabilitative training on motor recovery after ischemic infarct [see comments]. Science 272: 1791-1794
Seitz RJ, Höflich P, Binkofski F, Tellmann L, Herzog H, Freund H-J (1998) Role of the premotor cortex in recovery from middle cerebral artery infarction. Arch Neurol 55: 1081-1088
Seitz RJ, Azari NP, Knorr U, Binkofski F, Herzog H, Freund H-J (1999) The role of diaschisis in stroke recovery. Stroke 30: 1844-1850
Seitz RJ, Bütefisch CM, Kleiser R, Hömberg V (2004) Reorganization of cerebral circuits in human ischemic brain disease. Restorative Neurol Neurosci 22: 207-229
Wang X, Merzenich MM, Sameshima K, Jenkins WM (1995) Remodelling of hand representation in adult cortex determined by timing of tactile stimulation. Nature 378: 71-75
Weder B, Knorr U, Herzog H, Nebeling B, Kleinschmidt A, Huang Y et al (1994) Tactile exploration of shape after subcortical ischaemic infarction studied with PET. Brain 117: 593-605
Weiller C, Chollet F, Friston KJ, Wise RJ, Frackowiak RS (1992) Functional reorganization of the brain in recovery from striatocapsular infarction in man. Ann Neurol 31: 463-472
Weiller C, Ramsay SC, Wise RJ, Friston KJ, Frackowiak RS (1993) Individual patterns of functional reorganization in the human cerebral cortex after capsular infarction. Ann Neurol 33: 181-189
Witte OW, Bidmon H-J, Schiene K, Redecker C, Hagemann G (2000) Functional differentiation of multiple perilesional zones after focal cerebral ischemia. J Cereb Blood Flow Metab 20: 1149-1165